Bezpieczeństwo stosowania antagonistów witaminy K i bezpośrednich doustnych antykoagulantów – cz. 1
Udostępnij

Choroba zakrzepowa należy do najczęstszych powikłań po operacjach chirurgicznych, zwłaszcza ortopedycznych. Narażone są na nią głównie osoby długotrwale unieruchomione. Zwiększone ryzyko zakrzepicy dotyczy także chorych z migotaniem przedsionków oraz po przebytej operacji wszczepienia sztucznych zastawek serca. Leczenie ma celu ograniczenie powstawania skrzepów w naczyniach krwionośnych i jamach serca.1
Wśród leków hamujących krzepliwość krwi, stosowanych w zakrzepicy, można wyróżnić leki podawane dożylnie lub podskórnie, a także leki stosowane doustnie. W celu uzyskania szybkiego efektu podawana jest heparyna niefrakcjonowana lub jej pochodne (heparyny drobnocząsteczkowe). Leki stosowane doustnie to antagoniści witaminy K, do których zaliczamy acenokumarol i warfarynę, a także nowe doustne antykoagulanty.1,2 Do bezpośrednich doustnych antykoagulantów, direct oral anticoagulants (DOACs), należą: rywaroksaban, apiksaban, edoksaban i dabigatran.3 Klasyfikację ATC tych leków przedstawia Tabela 1. Odrębną grupę leków stosowanych doustnie stanowią leki przeciwpłytkowe. Można do nich zaliczyć kwas acetylosalicylowy, tikolipdynę, klopidogrel, a także nowe leki – prasugrel i tikagrelor. Wskazaniem do stosowania tej grupy leków jest profilaktyka przeciwzakrzepowa u osób ze zmianami miażdżycowymi, co ogranicza ryzyko zdarzeń sercowo-naczyniowych, takich jak udar mózgu lub zawał serca.3,5
| Klasyfikacja ATC | |
| B01A Leki przeciwzakrzepowe | |
| B01AE bezpośrednie inhibitory trombiny | |
| B01AE07 | eteksylan dabigatranu |
| B01AF Bezpośrednie inhibitory czynnika Xa | |
| B01AF01 | rywaroksaban |
| B01AF02 | apiksaban |
| B01AF03 | edoksaban |
Tabela 1. Klasyfikacja bezpośrednich doustnych antykoagulantów4.
Bezpośrednie doustne antykoagulanty wykorzystuje się w leczeniu zatorowości płucnej i zakrzepicy żył głębokich, a także w profilaktyce nawrotów tych chorób. Ponadto są stosowane w celu zapobiegania powikłaniom zakrzepowo-zatorowym po przebytych zabiegach chirurgicznych, np. alloplastyce stawu biodrowego i kolanowego. Wykorzystywane są także u pacjentów z migotaniem przedsionków jako prewencja udarów i zatorowości obwodowej przy współistniejących czynnikach ryzyka.6,7,8,9,10
Antagoniści witaminy K
Do powszechnie wykorzystywanych leków tej grupy należy warfaryna i acenokumarol. Mechanizm działania polega na hamowaniu działania witaminy K. Prowadzi to do powstawania niepełnowartościowych czynników krzepnięcia krwi (czynnik II, VII, IX, X) w wątrobie. Początek działania następuje dopiero po 2-4 dniach, ponieważ leki te nie działają na już wytworzone czynniki krzepnięcia.5 W przypadku stosowania warfaryny i acenokumarolu niezbędna jest kontrola czasu protrombinowego. Czas protrombinowy można wyrazić poprzez międzynarodowy współczynnik znormalizowany (INR). Z wartością INR związane jest dawkowanie antagonistów witaminy K, wobec czego schemat przyjmowania leku należy określić indywidualnie dla każdego pacjenta.3,5
Warfaryna i acenokumarol wykazują interakcje z wieloma lekami oraz pożywieniem. Do leków nasilających działanie antagonistów witaminy K można zaliczyć między innymi: antybiotyki, chemioterapeutyki (chinolony, sulfonamidy), leki przeciwgrzybicze stosowane ogólnoustrojowo (np. metronidazol, flukonazol), a także stosowane miejscowo (mikonazol), leki o działaniu hipolipemicznym (fibraty, statyny), leki antyarytmiczne (amiodaron, chinidyna), NLPZ, omeprazol, cymetydyna, hormony tarczycy, steroidy anaboliczne, androgeny. Istotną interakcję jest również zwiększenie działania hipoglikemizującego pochodnych sulfonylomocznika przez antagonistów witaminy K. Natomiast do leków osłabiających działanie warfaryny i acenokumarolu należą, np. rifampicyna, barbiturany, karbamazepina, doustne środki antykoncepcyjne, leki przeciwnowotworowe (np. azatiopryna), żywice wiążące kwasy żółciowe (kolestyramina), wyciągi z dziurawca. Także przyjmowanie dużych ilości witaminy K, zawartej w pokarmie osłabia działanie przeciwzakrzepowe.5,11,12
Do najczęstszych działań niepożądanych występujących podczas stosowania antagonistów witaminy K należą krwawienia. W sytuacji przedawkowania leku lub wystąpienia krwawienia istnieje swoiste antidotum – witamina K. W cięższych przypadkach, konieczne może być podanie świeżo mrożonego osocza.3,11,12
Bezpośrednie inhibitory czynnika Xa
Mechanizm działania rywaroksabanu, apiksabanu i edoksabanu polega na znoszeniu aktywności czynnika Xa w kaskadzie krzepnięcia krwi. Leki wpływają zarówno na wolny, jak i związany w kompleksie protrombinazy czynnik Xa.3 Miejsce działania tych leków na proces krzepnięcia krwi przedstawiono na Rycinie 1.
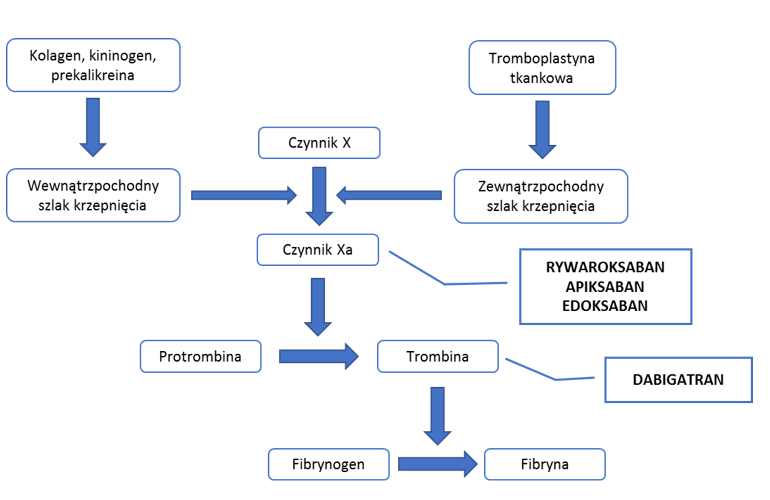 Rycina 1. Punkt uchwytu bezpośrednich doustnych antykoagulantów w procesie krzepnięcia krwi5.
Rycina 1. Punkt uchwytu bezpośrednich doustnych antykoagulantów w procesie krzepnięcia krwi5.
Rywaroksaban podany w dawce 15 mg lub 20 mg razem z posiłkiem, osiąga znacznie lepszą biodostępność, niż przy podaniu na czczo. Pokarm nie wpływa natomiast na biodostępność leku w dawce 2,5 mg i 10 mg.8,16 Pacjenci, którzy mają trudności z połknięciem tabletki mogą ją rozpuścić w wodzie lub rozgnieść i wymieszać z przecierem jabłkowym, a następnie niezwłocznie przyjąć.16 Apiksaban i edoksaban można przyjmować niezależnie od posiłku.9,10 W przypadku trudności w przyjęciu tabletek zawierających apiksaban można przygotować zawiesinę w wodzie, 5% wodnym roztworze dekstrozy lub w soku jabłkowym. Tabletkę można też rozkruszyć i przyjąć wraz z musem jabłkowym.17
Rywaroksaban po podaniu, osiąga stężenie maksymalne po około 2-4 godz. W dużym stopniu jest wiązany przez białka osocza (92-95%), głównie albuminy. Około 2/3 podanej dawki rywaroksabanu jest metabolizowana. Za metabolizm rywaroksabanu odpowiadają enzymy CYP3A4, CYP2J2, podlega także przemianom niezależnym od cytochromu P450. Lek jest także substratem dla glikoproteiny P i białka oporności raka sutka. Dawka leku, które podlega przemianom metabolicznym jest następnie wydalana w równej mierze droga nerkową i wątrobową. Pozostała 1/3 przyjętej dawki leku jest eliminowana drogą nerkową w niezmienionej postaci. Zaburzenia czynności nerek wpływają na zwiększenie stężenia rywaroksabanu w osoczu, przez co może być konieczne zmniejszenie stosowanej dawki. Także w przypadku pacjentów z zaburzeniami czynności wątroby siła działania rywaroksabanu, wyrażona przez stopień hamowania czynnika Xa jest większa. 8,16
Apiksaban osiąga stężenie maksymalne w osoczu po około 3-4 godz. od podania. Lek jest metabolizowany głównie przez enzymy CYP3A4/5, a także stanowi substrat dla glikoproteiny P, z czego wynikają interakcje apiksabanu. Ekspozycja organizmu na dawkę apiksabanu jest większa u pacjentów powyżej 65 r.ż., kobiet i pacjentów o masie ciała poniżej 50 kg. Natomiast u pacjentów o masie ciała powyżej 120 kg, stężenie leku jest mniejsze.9,17
W przypadku edoksabanu stężenie maksymalne jest osiągane po 1-2 godz. od przyjęcia dawki leku. W niewielkim stopniu jest metabolizowany przez CYP3A4/5. Podobnie jak rywaroksaban i apiksaban, stanowi substrat dla glikoproteiny P. Edoksaban jest usuwany głównie drogą nerkową. Dawkę leku należy skorygować przy niewydolności nerek (klirens kreatyniny 15-50 ml/min), a także gdy masy ciała pacjenta wynosi mniej niż 60 kg.10,18
Wszystkich inhibitorów czynnika Xa nie powinno się stosować u osób z ciężkimi zaburzeniami czynności nerek (klirens kreatyniny <15 ml/min). Leki te nie powinny być przyjmowane przez osoby z ciężką niewydolnością wątroby i chorobami wątroby związanymi z koagulopatią.16,17,18 Nie zaleca się jednoczesnego przyjmowania inhibitorów glikoproteiny P i enzymu CYP3A4 z rywaroksabanem i apiksabanem. Zahamowanie czynności glikoproteiny P i CYP3A4 prowadzi do wzrostu stężenia rywaroksabanu i apiksabanu w osoczu, co może nasilić działania niepożądane i wywołać krwawienie.8,9 Leki będące silnymi induktorami CYP3A4 i glikoproteiny P np. fenytoina, karbamazepina, mogą natomiast osłabiać działanie wszystkich inhibitorów czynnika Xa. 8,9,10,18 Interakcje inhibitorów czynnika Xa zostały przedstawione w Tabeli 2.
| Antykoagulant | Inny lek | Interakcja |
| rywaroksaban apiksaban | silne inhibitory glikoproteiny P i enzymu CYP3A4:
– pochodne triazolu (itrakonazol, posakonazol, worykonazol) – pochodne imidazolu (ketokonazol) – inhibitory proteazy HIV (rytonawir) |
wzrost stężenia rywaroksabanu i apiksabanu w osoczu, nasilenie działań niepożądanych, zwiększenie ryzyka krwawienia8,9,16,17 |
| induktory enzymu CYP3A4 i glikoproteiny P, np.:
– fenytoina – karbamazepina – ryfampicyna – preparaty zawierające dziurawiec |
zmniejszenie stężenia rywaroksabanu i apiksabanu w osoczu, osłabienie działania antykoagulantów8,9,16,17 | |
| – heparyna niefrakcjonowana
– heparyny drobnocząsteczkowe (enoksaparyna) – pochodne heparyny – doustne leki przeciwzakrzepowe (warfaryna) |
łączenie przeciwwskazane, z wyjątkiem przypadków zmiany leku8,9,17 | |
| inhibitory agregacji płytek krwi | należy zachować ostrożność, możliwe nasilenie krwawienia8,9,16,17 | |
| NLPZ | należy zachować ostrożność przy łączeniu leków, możliwe jest nasilenie krwawienia8,9,16 | |
| edoksaban | inhibitory glikoproteiny P:
– erytromycyna – cyklosporyna |
zwiększenie stężenia edoksabanu w osoczy, możliwe nasilenie działań niepożądanych, konieczne zmniejszenie dawki edoksabanu18 |
| induktory glikoproteiny P, np.:
– fenytoina – fenobarbital – karbamazepina – ryfampicyna – preparaty zawierające dziurawiec |
możliwe zmniejszenie stężenia edoksabanu w osoczu18 | |
| – heparyna niefrakcjonowana
– heparyny drobnocząsteczkowe (enoksaparyna) – pochodne heparyny – doustne leki przeciwzakrzepowe (warfaryna) |
łączenie przeciwwskazane, z wyjątkiem przypadków zmiany leku10,18 | |
| NLPZ | w badaniach klinicznych wykazano zwiększenie częstości krwawień, leków nie należy stosować jednocześnie przez dłuższy czas18 | |
| leki nasilające motorykę przewodu pokarmowego | zmniejszenie wchłaniania edoksabanu18 | |
| dabigatran | NLPZ, szczególnie o biologicznym okresie półtrwania dłuższym niż 12 godz. | wzrost ryzyka krwawienia6,19 |
| induktory glikoproteiny P – fenytoina, karbamazepina, ziele dziurawca, ryfampicyna | zmniejszenie stężenia dabigatranu w osoczu, osłabienie jego działania6 | |
| inhibitory glikoproteiny P stosowane układowo – itrakonazol, cyklosporyna | łączenie jest przeciwwskazane, możliwy wzrost stężenia dabigatranu6 | |
| – heparyna niefrakcjonowana
– heparyny drobnocząsteczkowe (enoksaparyna) – pochodne heparyny – antagoniści witaminy K – tienopirydyny (tiklopidyna, klopidogrel) |
łączenie przeciwwskazane, z wyjątkiem przypadków zmiany leku6,19 |
Tabela 2. Interakcje bezpośrednich doustnych antykoagulantów.
Dabigatran
Dabigatran jest podawany w postaci proleku – eteksylanu dabigatranu, który dopiero w wątrobie i osoczu ulega przekształceniu do formy aktywnej. Jego działanie wynika z blokowania aktywności trombiny, zarówno wolnej, jak i związanej z fibryną. Dabigatran hamuje także aktywację płytek wywołaną przez fibrynę.6 Miejsce działania dabigatranu na proces krzepnięcia krwi przedstawiono na Rycinie 1. Dabigatran występuje w postaci kapsułek, które są wypełnione peletkami. Peletek nie należy wysypywać z kapsułki, ponieważ może to spowodować zwiększenie dostępności biologicznej nawet o 75%. Lek można przyjmować zarówno na czczo jak i z posiłkiem, gdyż nie wpływa on na dostępność biologiczną. Przy podaniu wraz z posiłkiem wydłuża się czas, w jakim jest osiągane stężenie maksymalne o około 2 godziny.6,19 Skuteczność działania przeciwzakrzepowego dabigatranu zależy od jego stężenia w osoczu. Lek wiąże się w niewielkim stopniu z białkami osocza (34-35%). Siła działania zależy również od wydolności nerek, ponieważ lek w głównej mierze (85%) wydalany jest wraz z moczem. Działanie przeciwkrzepliwe jest sześciokrotnie silniejsze u osób z zaburzeniami czynności nerek (gdy klirens kreatyniny <30 ml/min), co stanowi przeciwwskazanie do stosowania dabigatranu. Przy niewydolności nerek, biologiczny okres półtrwania dwukrotnie się wydłuża.6 Interakcje dabigatranu są podobne do tych, które występują przy stosowaniu doustnych inhibitorów czynnika Xa. Eteksylan dabigatranu stanowi substrat glikoproteiny P, w związku z czym wchodzi w interakcję z lekami, które wpływają na ekspresję tego transportera błonowego. Leki będące inhibitorami glikoproteiny P mogą zwiększać stężenie eteksylanu dabigatranu. Natomiast silne induktory glikoproteiny P, np. karbamazepina, nasilają ekspresję tego transportera błonowego, w wyniku czego może dochodzić do zmniejszenia stężenia dabigatranu.6,19 Przykładowe interakcje dabigatranu zostały pokazane w Tabeli 2.
Autorzy:
mgr farm. Monika Talaga,
dr n. farm. Magdalena Markowicz-Piasecka,
Zakład Chemii Farmaceutycznej, Analizy Leków i Radiofarmacji,
Uniwersytet Medyczny w Łodzi
Artykuł pochodzi z 47 numeru kwartalnika „Farmakoekonomika Szpitalna”
Źródła:
- https://www.mp.pl/pacjent/zakrzepica/wszystkoozakrzepicy/profilaktyka/54408,metody-profilaktyki-zakrzepicy-zylnej, dostęp 07.01.2019 r.
- https://www.mp.pl/interna/chapter/B16.II.2.33.3., dostęp 07.01.2019 r.
- Korbut R., „Farmakologia”, PZWL, Warszawa 2017, 132-133, 460-463, 466-469, 473-475.
- https://www.whocc.no/atc_ddd_index/, dostęp 07.09.2018 r.
- Janiec W., „Farmakodynamika”, PZWL, Warszawa 2008, 512, 521-523, 526-527.
- https://indeks.mp.pl/leki/desc.php?id=7238, dostęp 22.08.2018 r.
- Fontana P., Robert-Ebadi H., Bounameaux H., Boehlen F., Righini M., Direct oral anticoagulants: a guide for daily practice, “Swiss Medical Weekly” 2016; 146:w 14286, https://smw.ch/en/article/ doi/smw.2016.14286/, dostęp 24.08.2018 r.
- https://indeks.mp.pl/leki/desc.php?id=7493, dostęp 24.08.2018 r.
- https://indeks.mp.pl/leki/desc.php?id=10069, dostęp 07.09.2018 r.
- https://indeks.mp.pl/leki/desc.php?id=15381, dostęp 07.09.2018 r.
- https://indeks.mp.pl/leki/desc.php?id=5616, dostęp 09.01.2019 r.
- https://indeks.mp.pl/leki/desc.php?id=43, dostęp 09.01.2019 r.
- Pruszczyk P., Tomaszuk-Kazberuk A., Słowik A., Drwiła R., Rydzewska G., Filipiak K.J., Gaciong Z., Kaźmierczak J., Marczyński W., Windyga J., Kobayashi A., Stępińska J.: Postępowanie w przypadku krwawienia lub pilnych zabiegów inwazyjnych u chorych leczonych bezpośrednimi doustnymi antykoagulantami – zalecenia dla polskich lekarzy w 2017 roku. Med. Prakt., 2018; 3: 25–44, https://www.mp.pl/zakrzepica/wytyczneartykuly/wytyczne/182470, dostęp08.2018 r.
- https://kardiologia.mp.pl/publikacje/nowe-wyniki-badan/150885,czy-nowe-doustne-antykoagulanty-sa-bezpieczniejsze-w-leczeniu-migotania-przedsionkow-niz-warfaryna, dostęp 09.09.2018 r.
- Hu T.Y., Vaidya V.R., Asirvatham S.J., Reversing anticoagulant effects of novel oral anticoagulants: role of ciraparantag, andexanet alfa and idarucizumab, Vasc Health Risk Manag. 2016; 12: 35–44., https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4762436/, dostęp 11.09.2018 r.
- Xarelto – Charakterystyka Produktu Leczniczego, http://leki.urpl.gov.pl/files/32_Xarelto _15mg.pdf, dostęp 08.01.2019 r.
- Eliquis – Charakterystyka Produktu Leczniczego, http://leki.urpl.gov.pl/files/28_Eliquis.pdf, dostęp 08.01.2019 r.
- Lixiana – Charakterystyka Produktu Leczniczego, https://ec.europa.eu/health/documents/ community-register/2015/20150619132091/anx_132091_pl.pdf, dostęp 10.09.2018 r.
- Dabigatran – Charakterystyka Produktu Leczniczego, https://ec.europa.eu/health/documents/ community-register/2008/2008031840552/anx_40552_pl.pdf, dostęp 06.01.2018 r.
- https://www.accessdata.fda.gov/scripts/cder/ob/results_product.cfm?Appl_Type=N&Appl_No=208383, dostęp 07.02.2019 r.
- Bevyxxa – Charakterystyka Produktu Leczniczego, https://www.accessdata.fda.gov /drugsatfda_docs/label/2017/208383s000lbl.pdf, dostęp 08.02.2019 r.


